Zawartość
- etapy
- Część 1 Znajdź elektrony walencyjne z układu okresowego
- Elementy nieprzechodzące
- Metale przejściowe
- Część 2 Znajdź elektrony walencyjne z konfiguracji elektronicznej
W chemii walencyjne elektrony to elektrony znajdujące się na ostatniej warstwie, a zatem zewnętrznej atomu. Znajomość elektronów walencyjnych atomu pozwala lepiej zrozumieć lub lepiej przewidzieć reakcje chemiczne, ponieważ są one związane z wiązaniami chemicznymi. W rzeczywistości nie jest to bardzo skomplikowane, wystarczy umieć czytać układ okresowy pierwiastków.
etapy
Część 1 Znajdź elektrony walencyjne z układu okresowego
Elementy nieprzechodzące
-

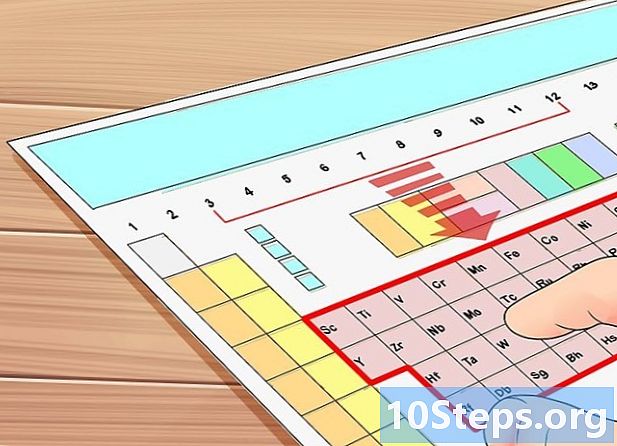
Zdobądź układ okresowy pierwiastków. Jest to stół z kolorowymi kwadratami z listą wszystkich znanych do tej pory elementów. Oprócz nazw pierwiastków, ta tabela zawiera wiele innych informacji, z których niektóre pozwalają poznać liczbę elektronów wartościowości danego atomu. Ta tabela znajduje się we wszystkich książkach o chemii, ale są one również w Internecie, a niektóre są nawet interaktywne, jak w tym przypadku. -

Ponumeruj kolumny układu okresowego. Liczba od 1 do 18. Na stole elementów każda kolumna reprezentuje rodzinę elementów, z których wszystkie mają tę samą liczbę elektronów walencyjnych. Jeśli numery kolumn nie są zaznaczone, możesz to zrobić, zaczynając od lewej strony od pierwszej grupy, a kończąc po prawej osiemnastej. Te kolumny to w rzeczywistości „grupy ».- Tak więc, jeśli pracujesz z tablicą nienumerowaną, napiszesz 1 powyżej wodoru (H), 2 powyżej berylu (Be) i tak dalej. Kiedy dotrzesz do Helu (He), wejdziesz do 18.
-

Znajdź swój przedmiot w tabeli. Musisz zlokalizować w tabeli, gdzie jest element, który chcesz poznać elektrony walencyjne. Możesz wyszukać symbol, liczbę atomową lub dowolne inne posiadane informacje.- Będziemy więc szukać elektronów walencyjnych bardzo powszechnego pierwiastka na Ziemi: węgiel (C). Ten pierwiastek ma liczbę atomową 6 i znajduje się na górze grupy 14. W następnym kroku określimy jego elektrony walencyjne.
- W tej podczęści nie będziemy rozważać metali przejściowych, które wszystkie są pogrupowane między kolumnami 3 i 12 tabeli.Elementy te różnią się od innych elementów, omówimy je w następnym podrozdziale.
-

Liczba grupy pozwala poznać liczbę elektronów wartościowości. Rzeczywiście, możliwe jest określenie liczby elektronów wartościowości atomu, wiedząc, do której grupy należy. Liczba elektronów wartościowości atomu to liczba jednostek numeru grupy. Innymi słowy:- kolumna 1: 1 elektron walencyjny,
- kolumna 2: 2 elektrony walencyjne,
- kolumna 13: 3 elektrony walencyjne
- kolumna 14: 4 elektrony walencyjne,
- kolumna 15: 5 elektronów walencyjnych,
- kolumna 16: 6 elektronów walencyjnych,
- kolumna 17: 7 elektronów walencyjnych,
- kolumna 18: 8 elektronów walencyjnych, z wyjątkiem helu, który ma tylko 2.
- Zatem, ponieważ węgiel należy do grupy 14, można argumentować, że węgiel 4 elektrony walencyjne.
Metale przejściowe
-

Znajdź przedmiot z grup od 3 do 12. Jak wspomniano wcześniej, elementy należące do tych grup nazywane są „metalami przejściowymi”, ponieważ zachowują się inaczej niż inne pierwiastki, o ile mówimy o elektronach walencyjnych. Spróbujemy częściowo wyjaśnić, dlaczego często niemożliwe jest łatwe określenie liczby wartościowości elektronowej tych konkretnych atomów.- Weźmy jako przykład tantal (Ta), element o numerze 73. W kolejnych krokach określimy jego elektrony walencyjne (w końcu, spróbujemy !)
- Lantanowce i aktynowce (zwane także „ziemami rzadkimi”) są klasyfikowane jako metale przejściowe. Elementy te pojawiają się w dwóch liniach pod tabelą ogólną: lantan inauguruje serię lantanowców w pierwszej linii, podczas gdy aktynowce w drugiej linii zaczynają się od laktinium. Wszystkie te elementy należą grupa 3 układu okresowego pierwiastków.
-

Metale przejściowe nie mają „klasycznych” elektronów walencyjnych. Aby zrozumieć, dlaczego tak się dzieje, potrzebujemy wyjaśnień dotyczących zachowania elektronów tych pierwiastków, zwłaszcza tych znajdujących się na ostatniej warstwie. Jeśli chcesz dowiedzieć się więcej, czytaj dalej, w przeciwnym razie przejdź do następnego kroku.- Kiedy elektrony są szczepione na atomie, są one rozmieszczone w pewnych obszarach zwanych „orbitaliami”. Są to, wokół każdego jądra, strefy agregacji elektronów. Elektrony walencyjne to w większości przypadków te znajdujące się na zewnętrznej pod-warstwie. Liczymy tych, którzy już są na miejscu, a także tych, którzy przybyli do aglomeracji po reakcji.
- Z powodów, które są zbyt długie, aby je tu wyjaśnić, wiedz, że kiedy elektrony dołączą do warstwy podkładowej d, najbardziej zewnętrzna część metalu przejściowego (patrz poniżej), pierwsze elektrony osiadają na tej warstwie i można je uznać za konwencjonalne elektrony walencyjne, ale szybko też się nie zachowują. Równolegle elektrony leżące na innych warstwach elektronicznych mogą zachowywać się jak elektrony walencyjne. Rozumiesz, że atom może mieć zmienną liczbę wartościowości elektronów w zależności od reakcji, w którą jest zaangażowany.
- Aby uzyskać więcej wyjaśnień, nawet jeśli jest w języku angielskim, sprawdź doskonałą stronę elektronów walencyjnych w Clackamas Community College.
-

Określ liczbę elektronów walencyjnych na podstawie numeru grupy. Ten ostatni rzeczywiście pozwoli ci znaleźć liczbę wartościowości elektronów. Niestety! Nie działa to w przypadku metali przejściowych, w których liczba elektronów walencyjnych mieści się w pewnym zakresie, a mianowicie:- elementy kolumny 3: 3 elektrony walencyjne,
- elementy kolumny 4: od 2 do 4 elektronów walencyjnych,
- elementy kolumny 5: od 2 do 5 elektronów walencyjnych,
- elementy kolumny 6: od 2 do 6 elektronów walencyjnych,
- elementy kolumny 7: od 2 do 7 elektronów walencyjnych,
- elementy kolumny 8: 2 lub 3 elektrony walencyjne,
- elementy kolumny 9: 2 lub 3 elektrony walencyjne,
- elementy kolumny 10: 2 lub 3 elektrony walencyjne,
- elementy kolumny 11: 1 lub 2 elektrony walencyjne,
- elementy kolumny 12: 2 elektrony walencyjne.
- Weźmy przykład tantalu. Należy do grupy 5: możemy powiedzieć, że ma, w zależności od przypadku, pomiędzy dwa i pięć elektronów walencyjnych.
Część 2 Znajdź elektrony walencyjne z konfiguracji elektronicznej
-

Dowiedz się, jak odszyfrować konfigurację elektroniczną. Elektrony walencyjne elementu można znaleźć w konfiguracji elektronicznej. Terminy są przerażające, ale ten ostatni jest jedynie praktycznym sposobem przedstawienia orbity atomu za pomocą liter i cyfr. Kiedy się przyzwyczaisz, zobaczysz, że jest to po prostu proste.- Rzućmy okiem na elektroniczną konfigurację elementu sodowego (Na):
- 1s2s2p3s
- Orbitalna konfiguracja elektroniczna ma postać szeregu cyfr (lub cyfr) i liter w następujący sposób:
- (Number) (pismo) (numer) (list) ...
- Część (Number) (pismo) odpowiada rodzajowi lorbitalu i części określa liczbę elektronów na poprzednim lorbicie. Proste, nie?
- Możemy więc powiedzieć, że sód ma 2 elektrony w lorbitalnych 1s, 2 elektrony w lorbital 2s, 6 elektronów w lorbital 2p i 1 elektron w odcinku lorbitalnym 3s, Mamy w sumie 11 elektronów, przy czym sód ma liczbę atomową 11: liczba jest dobra!
- Pamiętaj, że każda warstwa podkładowa ma specjalną zdolność do elektronów.
- s: pojemność 2 elektronów
- p: pojemność 6 elektronów
- d: pojemność 10 elektronów
- f: pojemność 14 elektronów
- Rzućmy okiem na elektroniczną konfigurację elementu sodowego (Na):
-

Ustal konfigurację elektroniczną swojego elementu. Po ustaleniu tej konfiguracji łatwo jest znaleźć liczbę elektronów walencyjnych (z wyjątkiem oczywiście metali przejściowych). Jeśli podasz konfigurację w jednym ćwiczeniu, możesz przejść do następnego kroku, w przeciwnym razie przeczytaj:- Oto struktura elektronowa lununoctium (Uuo), element 118:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Z tego przykładu, który dotyczył pierwiastka o dużej liczbie atomowej, musisz być w stanie skonstruować konfigurację elektroniczną dowolnego pierwiastka zgodnie z zasadami. Po prostu umieść wszystkie elektrony w swoim elemencie na właściwych orbitach. To łatwiejsze niż się wydaje. Zatem jeśli chcesz podać orbitalną konfigurację elektronową chloru (Cl) o liczbie atomowej 17, to znaczy 17 elektronów, musisz napisać w następujący sposób:
- 1s2s2p3s3p
- Elektrony sumują się, dając 17: 2 + 2 + 6 + 2 + 5 = 17. Jak widać, wystarczy zmienić liczbę elektronów na ostatnim orbicie. Pozostałe orbitale, które są pełne, nie ulegają zmianie.
- Aby dowiedzieć się więcej o konfiguracji atomów, przeczytaj ten artykuł.
- Oto struktura elektronowa lununoctium (Uuo), element 118:
-

Rozwachluj elektrony na ich orbitale za pomocą reguły loctet. Podczas reakcji chemicznej elektrony są na przykład dodawane do atomu przez tonięcie w określonych obszarach, orbitali, w określonej wyżej kolejności. Jeśli powstaje nowy atom, pierwsze dwa elektrony krążą po orbicie 1s, następne dwa na orbicie 2s, następne sześć na orbicie 2pitd. Z elementami nieprzechodzącymi orbitale tworzą „podwarstwy” wokół jądra, z których każdy znajduje się dalej od jądra niż poprzednie. Z wyjątkiem pierwszej warstwy podkładowej, która może zawierać tylko dwa elektrony, wszystkie pozostałe mogą zawierać osiem elektronów (z wyjątkiem, powtórzmy to, w przypadku metali przejściowych). To jest reguła loctet.- Weźmy więc przypadek boru (B). Jego liczba atomowa wynosi 5, wiemy, że 5 elektronów krąży wokół jądra zgodnie z następującym rozkładem: 1s2s2p. Wiedząc, że pierwsza warstwa może zawierać tylko dwa elektrony, możemy wywnioskować, że bor ma dwie warstwy: pierwsza z 2 elektronami (orbital 1s) i drugi z 3 elektronami (2 na orbicie 2s i 1 na orbicie 2p).
- Weźmy inny przykład: chlor. Ten element ma trzy warstwy elektroniczne: pierwszą z pojedynczym orbitalem (1s) z dwoma elektronami, druga warstwa z dwoma orbitali (2s i 2p) posiadające odpowiednio 2 i 6 elektronów, a na końcu trzecią warstwę z dwoma orbitali (3s i 3p) posiadających odpowiednio 2 i 5 elektronów, przy czym ostatnia warstwa jest niekompletna.
-

Znajdź liczbę elektronów na zewnętrznej warstwie. Znając liczbę warstw elektronicznych elementu, łatwo jest znaleźć liczbę elektronów wartościowości: jest to liczba elektronów, które grawitują na ostatniej warstwie. Jeśli ten drugi jest pełny (albo dwa elektrony dla jednej warstwy, albo osiem dla wszystkich pozostałych), mówi się, że element jest „obojętny” (są to „gazy szlachetne”), co oznacza, że elementy o takiej strukturze są trudne do pękają podczas reakcji chemicznej. Ponownie, metale przejściowe mają różne zachowania.- Tak więc, jeśli chodzi o bor, wiedząc, że na drugiej warstwie znajdują się trzy elektrony, możemy więc powiedzieć, że bor ma trzy elektrony walencyjne.
-

Użyj wierszy układu okresowego. Wiersze układu okresowego nazywane są „okresy ”. Od góry do dołu tabeli pierwiastki chemiczne z tego samego okresu mają tę samą liczbę warstw elektronicznych. Taki układ tabeli pozwala szybko określić liczbę elektronów walencyjnych w elemencie. Policz od lewej: pierwszy element, pojedynczy elektron, drugi element, dwa elektrony itp. Metale przejściowe nie powinny być brane pod uwagę.- Tak więc selen ma cztery warstwy elektroniczne, ponieważ należy do czwartego okresu. Ponieważ jest to szósty element linii, od lewej, z wyłączeniem metali przejściowych, czwarta i ostatnia warstwa ma sześć elektronów. Dlatego selen ma sześć elektronów walencyjnych.


